京大呼吸器外科 京都大学医学部附属病院呼吸器外科
移植
当教室は1983年に肺移植の研究を開始して以来、常に世界の肺移植研究の先端を開拓してきました。
気管支吻合部粘膜血流の研究、肺移植における免疫抑制剤FK506の効果の検討などから、最近では優れた肺保存液の開発と虚血再潅流傷害の抑制及びそのメカニズムの解明に重点を置き研究を進めてきました。
肺移植は、1983年のトロント大学での初の臨床成功例報告以来、欧米を中心に急速に普及し、今日では末期肺疾患に対する治療手段として確立されています。
本邦でも1998年の生体肺移植に引き続き、2000年には初の脳死肺移植が施行された。京都大学呼吸器外科では、2002年に初の生体肺移植を行い、2004年4月現在2例の生体肺移植、2例の脳死肺移植を成功裡に行っています。
現在の肺移植はこの約20年間の世界中での肺移植研究の成果により1983年当時からは大きく進歩しています。我々の研究成果も臨床にフィードバックされ、肺移植の進歩に寄与してきたと自負しています。
《1》現在の研究
- 独自に開発した臓器・組織保存液ET-Kyoto液の実用化
- 心停止ドナーからの肺移植を想定した研究
- IloprostによるEndothelin-1の抑制と肺虚血再潅流傷害の軽減
- ミニブタモデルを用いた移植免疫学の研究
- 酸化還元 (redox) 調節因子チオレドキシンの急性肺傷害における保護効果
1. 独自に開発した臓器・組織保存液ET-Kyoto液の実用化
肺,心臓,腎臓,肝臓,小腸,膵臓などさまざまな臓器の末期機能不全に対する臓器移植は近年我が国でも定着しつつあります。また、事故や労働災害などにおいて発生した切断肢指の再接着術が可能であることも次第に知られつつあります。しかし、臓器移植や切断肢指再接着術においては,手術が完了し移植臓器や切断肢指の血流が再開されるまでの間,血流が途絶することは避けられません(虚血)。このため、手術に成功し良好な術後臓器能を得るためには,虚血時間を出来るだけ短くするとともに、虚血中の臓器を可能な限り良好な状態で保存することが必要です。また、本邦はもとより世界的に移植に提供いただける臓器(ドナー)数は極めて不足しており、移植手術を受けることなく死亡される患者さんも多数おられます。臓器保存方法の改良は、より遠隔地に発生した臓器の使用を可能にし、ドナー不足の改善に大きく改善します。
我々は、臓器保存において重要な役割を果たす臓器保存液の改良に長年携わり、独自にET-Kyoto液ならびにnew ET-Kyoto液を開発しました。ET-Kyoto液はストレス下で細胞保護作用をもたらす非還元性二糖類トレハロースと、低いカリウム濃度(細胞外液型電解質組成)を特長とする,臓器・組織保存液です。また、New ET-Kyoto液は血管内皮保護作用を有するN-acetyl L ミcysteine, dibutyryl cAMP, nitroglycerinをET-Kyoto液に添加したものです。
これまで,われわれは、
1) ET-Kyoto液ならびにnew ET-Kyoto液の優れた肺,腎臓,筋肉,皮膚の保存効果を実験的に証明しました。ET-Kyoto液は20時間,new ET-Kyoto液は、30時間の犬肺保存を可能にし,その効果は,世界中で頻用されるUniversity of Wisconsin液,Euro-Collins液やLow Potassium Dextran Glucose 液よりも優れています。
2) 京都大学医学部附属病院において2004年4月現在、2例の生体肺移植、5例の生体腎移植にET-Kyoto液を使用した。また,他大学および他医療機関における1例の肺移植、6例の腎移植,数例の切断肢指再接着手術にも,ET-Kyoto液を提供しました。
3)株式会社キョウトバイオメディカルサイエンスに技術提供を行い,同社はET-Kyoto液の市販化を開始しました。その後、2005年 秋、ET-Kyoto液の特許は株式会社大塚製薬工場に譲渡されまし た。今後は、同社と京都大学呼吸器外科が協力して開発を進める予定です。
4) 肝保存,膵保存におけるET-Kyoto液の効果検討を,他大学・他施設との共同研究として開始しました。
ET-Kyoto液(Fig.1)に興味を持たれる方は,京都大学呼吸器外科宛にご連絡頂ければ幸いです。
2. 心停止ドナーからの肺移植を想定した研究
本邦での肺移植術後の5年生存率は75%を超え、欧米の50%程度を凌駕していますが、ドナー不足は、欧米よりはるかに深刻です。ドナー不足を打開する手段として、マージナルドナー肺の使用、心停止ドナー(non-heart-beating donor, NHBD)肺の使用、異種移植などが考えられますが、NHBD肺を用いた肺移植が、最も現実的な代替手段として、近年、着目されています。平成17年度(11月末まで)で、脳死腎移植が行われたのは16例のみであるのに対し、心停止後腎移植が行われたのは134例との本邦の報告からも、NHBD肺が使用可能になれば、肺移植においても、ドナーはかなり増えると推測されます。
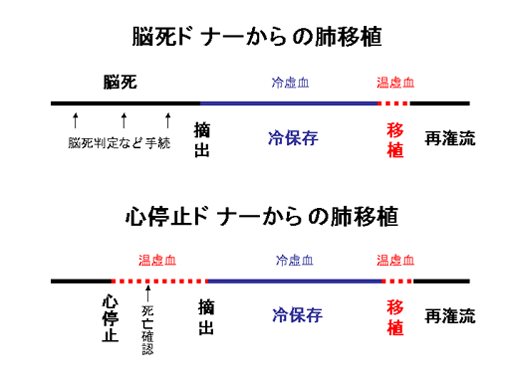
京都大学呼吸器外科グループが過去に行った肺内エネルギーやミトコンドリアの機能障害の研究、また、米国のEganらによる電子顕微鏡や免疫組織学的研究などから、実験的にはNHBD肺が使用可能であることが示されてきました。SwedenのSteenらが2000年に世界で初めてNHBD肺を用いた臨床肺移植に成功しましたが、臨床NHBD肺移植の広がりはいまだ遅々としています。NHBDを用いた肺移植においては、脳死ドナーからの肺移植とは異なり、心停止から肺の冷保存を行うまでの「温虚血」の存在があります(図)。この温虚血時間中には、急速に肺傷害が進行し、移植後早期の主要な死亡原因であるprimary graft failureの要因となります。つまり、NHBD肺移植においては、温虚血に伴う肺傷害を正確に評価し軽減することが、術後成績を保つために重要となるのです。
この観点から、われわれは、ratのex vivo肺潅流モデルを用いて温虚血に伴う肺傷害モデルを作成し、これに肺保護薬剤を投与することで肺虚血再潅流傷害を軽減すべく検討を行っています。薬剤の投与経路として、心停止(=循環停止)状態において、気道の存在という肺の特殊性に着眼し、吸入投与を選択しております。まず、虚血再潅流傷害における最初のターゲットが、血管内皮細胞の細胞間接着の破綻であることと、細胞内のcAMPの維持が細胞膜の安定性の維持に重要であることから、喘息・肺気腫の臨床頻用される長期作用型β受容体作動薬salmeterol xinafoate(セレベント?)を温虚血中に吸入投与することで、肺内のcAMPを保持し、虚血再潅流傷害を軽減することに成功しました。さらに、種々の薬剤の投与や、大動物を用いた追実験なども現在進行形であります。これら一連の研究により、実用化への道半ばである、臨床NHBD肺移植の進歩に、大きく寄与したいと考えております。
3. IloprostによるEndothelin -1の抑制と肺虚血再潅流傷害の軽減
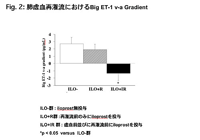
肺虚血再潅流傷害(Fig.2)は肺血管抵抗の上昇などを特徴とし、肺移植の成績を左右する要因のひとつです。プロスタグランジン(PGE1とPGI2 = プロスタサイクリン)は血管拡張、血小板や好中球の凝集抑制、活性酸素消去、血管内皮細胞の保護などの作用を持ち、脳死ドナーからのグラフト肺摘出の際に使用されています。一方、心筋梗塞、原発性肺高血圧症、肺虚血再潅流などで血管収縮ペプチドであるEndothelin (ET) -1の有意な増加が報告されています。われわれはラット体外循環モデルを用いた実験でiloprost(プロスタサイクリン)による虚血再潅流時の肺血管抵抗の低下、酸素化能の有意な改善を確認しました。またET-1の前駆体であるbig ET-1を肺静脈からの灌流液と肺動脈への流入液中で測定しその差(big ET-1 v-a gradient)を比較したところ、iloprost投与による肺内big ET-1の減少が確認されました。以上よりiloprostは肺内のET-1産生抑制またはET-1クリアランスの改善を通して虚血再潅流傷害を軽減することが示唆されました。
4.ミニブタモデルを用いた移植免疫学の研究
2002年より当呼吸器外科の教室員が、ハーバード大学医学部マサチューセッツ総合病院の研究施設であるTransplantation Biology Research Center (TBRC) にて、リサーチフェローとして研究に従事しています。研究の柱は慢性拒絶病変のメカニズムの解明と、免疫寛容の導入、異種移植などで、TBRC内のcardiothoracic laboratoryにて肺移植、心臓移植、心・腎同時移植のモデルを用いた研究が行われています。移植には「Dr. Sachs(TBRCのDirector)のminiature swine(ミニブタ: 体重 約20kg-40kg)」を使います。このブタは、ラットなどの小動物のように、MHC (class I とclass II)が判明しており、MHCのタイプにあわせてレシピエント、ドナーのペアを選び、class I mismatchの肺移植や、class II mismatchの心移植などを自由にデザインでき、さまざまなプロジェクトが進行しています。
当教室から留学したリサーチフェローは、肺移植(左肺移植モデル)のプロジェクトを主に担当しており、以下のテーマの実験を進行しています。
1) ドナーMHCペプチド間接認識の、慢性拒絶病変における役割の解明
2) 大動物肺移植における初めての reproducibleな免疫寛容モデルの開発
3) より短期間で完成する慢性拒絶病変モデルの開発
4) 肺内自己蛋白・の慢性拒絶病変における役割の解明
5) Chimerismによる肺移植免疫寛容導入
現在の肺移植医療において、有効な免疫抑制剤を用いた術後療法の進歩が術後早期の治療成績を以前より向上させていることは明らかですが、術後1年以降の生存率も同様に向上しているとは言えず、その最大の原因は慢性拒絶病変の発生であることが指摘されています。
以上の実験により得られる知見は、肺移植後拒絶病変、特に慢性拒絶病変をめぐってレシピエント内でおこるさまざまな生体反応のメカニズムを解明し、今後の肺移植医療に貢献することが期待されます。また、ヒトとほぼ同じサイズの臓器をもつミニブタを用いて行う移植免疫学研究は、異種移植のドナー候補としての可能性を模索するという側面も持っています。
5.酸化還元 (redox) 調節因子チオレドキシンの急性肺傷害における保護効果
淀井ら(京都大学ウイルス研究所)は、成人T細胞白血病由来因子(ATL-derived factor, ADF)としてヒトチオレドキシン(hTRX)を遺伝子クローニングしました。hTRXは105個のアミノ酸からなる分子量12kDの小さな蛋白で、その活性部位に存在するふたつのシステインの間でdithiol/disulfide交換反応を行う酸化還元(レドックス)調節蛋白です。TRXは種々の酸化ストレスにより誘導され、抗酸化作用を示すほか、細胞内のシグナル伝達分子や転写因子の活性化を調節します。またTRXは細胞外に放出され、細胞外から投与すると細胞内に取り込まれることも明らかになりつつあります。
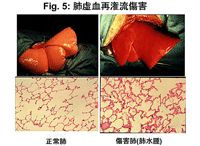
リコンビナントhTRXのさまざまな臓器障害に対する保護効果が報告されており、わたしたちはこれまでに、淀井らとの共同研究として、肺の温虚血再潅流(Fig.5)においてhTRXが肺組織傷害を軽減し、酸素化能やその他の呼吸生理機能を改善し、肺浮腫の招来を抑制することを報告しました。
リコンビナントhTRXの急性肺障害に対する保護効果の検討は、2003年より京都大学医学部附属病院探索医療センターで開始されましたが、我々も共同研究者として研究に参画しています。
《2》過去の研究成果
- ドナー肺温阻血時間の安全限界
- 肺移植後気管支吻合部粘膜血流
- 肺移植における免疫抑制剤FK506の効果
- 新しい拒絶反応早期診断法
- 新しい臓器組織保存液ET-Kyoto液の開発
- 肺虚血再潅流傷害の抑制
6-1: 抗酸化物質としてのADF/hTRXとニトログリセリン
6-2: ミトコンドリアと虚血再潅流傷害
6-3: 非必須アミノ酸グリシンによる肺冷虚血再潅流傷害の抑制
1.ドナー肺温阻血時間の安全限界
臓器移植においては冷虚血のみならず、臓器の摘出や移植中の温阻血も移植後の臓器傷害に大きく影響すると考えられる。我々は、イヌ肺移植実験にてドナー肺温阻血時間の安全限界が120分であることを示しました(Jpn J Surg 1989)。
2.肺移植後気管支吻合部粘膜血流
気管支吻合部の治癒不全は、肺移植のみならず、気管支形成術などの手術においても術後合併症として大きな問題であります。これに対して我々は、治癒不全に吻合部粘膜血流が関与していることをレーザードップラー血流測定を用いて初めて証明しました(Transplantation 1989)。
次に、この血流測定法を用いて、移植直後からのステロイド投与が気管支吻合に影響を与えないことを証明しました(J Thorac Cardiovasc Surg 1990)。現在多くの施設で移植直後から免疫抑制剤の中心の一つとしてステロイド投与がなされています。
3.肺移植における免疫抑制剤FK506の効果
イヌ肺移植実験にてFK506が有効な免疫抑制剤であることを、組織学的及びレーザードップラー血流測定を用いて証明しました(J Thorac Cardiovasc Surg 1992)。
さらに、FK506とシクロスポリンの低用量併用が、副作用を軽減し、単剤よりも有効であることを示しました(J Thorac Cardiovasc Surg 1992)。
現在多くの施設でFK506(タクロリムス)が肺移植における免疫抑制剤の一つとして用いられています。
4. 新しい拒絶反応早期診断法
レドックス制御因子チオレドキシンが種々のストレスによって誘導されます。
そこで我々は、イヌ肺移植実験にてチオレドキシン発現細胞が移植肺組織や肺胞洗浄液中に増加してくることを見出し、肺移植拒絶反応モニターとして有用であることを示した(J Thorac Cardiovasc Surg 1995, Chest 1995)。
5. 新しい臓器組織保存液の開発
現在臨床で用いられている臓器保存液では、安全な肺保存時間は6時間以内とされています。
また、ドナー肺不足の問題は深刻で、アメリカにおける平均肺移植待機時間は18か月以上と報告されており、待機中の死亡例も多くみられています。もしも保存液の改良により安全な保存時間を延長することができれば、移植可能なドナー肺の増加につながるだけでなく、手術が準待機的に実施可能となり、移植手術成績の向上にもつながる可能性があります。
現在多くの施設で用いられている標準的な保存液は、細胞内液型組成をもったmodified Euro-Collins (EC) 液であります。肝や腎などで保存時間を延長することが示されたUniversity of Wisconsin (UW) 液は肺でもその有効性が期待されましたが、今のところの評価はEC液と大きく変わるものではなく、貯蔵期間中の成分変化もあるため、多くの課題が残されています。
そこで我々は、長時間の良好な肺保存を可能にする新しい肺保存液の開発研究を行ってきました。 まず、種々の環境ストレス下において細胞膜構造の安定化ないし保護作用を有する非還元性二糖類トレハロースに着目しました。12時間イヌ肺保存実験において、通常のEC液のグルコースをトレハロースで置換することでより良い保存効果を得られることを示しました(Surgery 1994)。
次に、トレハロースを含む新しい保存液ET-Kyoto液(細胞外液型)とIT-Kyoto液(細胞内液型)を開発し、20時間イヌ肺保存実験を行いました。その結果、ET-Kyoto液がEC液よりも有効であることを示しました(J Thorac Cardiovasc Surg 1994)。
しかし、ET-Kyoto液による30時間肺保存は不十分で、肺動脈血管内皮傷害が走査電子顕微鏡などを用いた検討で明らかとなりました。このため、肺血管内皮傷害軽減を目的にN-アセチルシステイン、dibutyryl cAMP、ニトログリセリンをET-Kyoto液に添加し、new ET-Kyoto液を開発しました。
われわれはnewET-Kyoto液を用いて、30時間イヌ肺保存実験を成功させ、new ET-Kyoto液がUW液よりも有効であることを示しました(Ann Thorac Surg 1996)。さらに、ラットex vivo 潅流モデルを用いて、dibutyryl cAMPの血管内皮保護効果(J Thorac Cardiovasc Surg 1997)、ニトログリセリンの酸化ストレス軽減効果(Am J Respir Crit Care Med 2000)をそれぞれ明らかにしました。
6.肺虚血再潅流傷害の抑制
移植後早期のグラフト機能不全は術後早期死亡の主な原因ですが、これには虚血再潅流傷害が関与しているとされています。
肺に限らず、ドナー臓器はドナー臓器は血管内のその血液を洗い流すために一旦保存液で潅流され、虚血(血流の途絶)状態で冷保存された後に移植され、臓器への血流が再開される。すなわち、冷保存と虚血再潅流は、移植手術において避けることのできない過程といえます。 虚血再潅流傷害とは虚血臓器に血流が再開され、酸素供給がなされることによって臓器に生じる傷害であります。
虚血再潅流傷害の成因には多くの複雑な要因が関与していますが、再酸素化において生じる活性酸素(フリーラジカル)が重要な役割を果たしていることが知られています。すなわち虚血再潅流傷害の抑制は、グラフト肺の機能の改善につながり、より長い肺保存が可能になります。
- 6-1:抗酸化物質としてのADF/hTRXとニトログリセリン
- 成人T細胞白血病由来因子ADFは、大腸菌の還元酵素チオレドキシン(TRX)のヒトホモログです。ADF/hTRXは多様な活性を有しますが、その一つとして活性酸素除去が証明されています。
我々は、ADF/hTRXが肺虚血再潅流傷害の抑制に有効であることを、イヌ肺移植モデル(J Thorac Cardiovasc Surg 1994)、ラットex vivo 潅流モデル(Eur Surg Res 1995)、ラビットin vivoモデル(J Thorac Cardiovasc Surg 1997)、in vitroモデル(J Cell Physiol 2000)などで明らかにしてきました。 また、NO ドナーであるニトログリセリンが肺虚血再潅流傷害抑制に有効であることを、前述の保存液に添加する実験で明らかにしています。
そして、これらの物質が酸化ストレスを抑制するメカニズムを8-OHdG(Am J Respir Crit Care Med 2000)、DCFH-DA(J Cell Physiol 2000)、ルシフェリン類似体(J Thorac Cardiovasc Surg 1997)を用いて明らかにしてきました。
- 6-2: ミトコンドリアと虚血再潅流傷害
- 肺における虚血再潅流傷害がミトコンドリアの機能不全と密接に関連していることを、超微形態学的(Eur Surg Res 1999)あるいは生化学的手法を用いて示してきました(J Surg Res 2001)。
- 6-3: 非必須アミノ酸グリシンによる肺冷虚血再潅流傷害の抑制
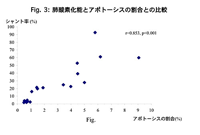
- 臨床肺移植は末期呼吸不全に対する治療法として確立されつつあるが、肺冷保存許容時間は短く、また、移植後の再潅流傷害は約20%の症例に生じ、移植早期の重大な合併症の一つです。近年calpain proteaseが細胞内カルシウムの増加を抑制することで虚血神経細胞障害を抑制すると注目されています。今回、我々は独自に開発した臓器・組織保存液(ET-Kyoto液)とcalpain proteaseとしての機能も期待でき生体に安全な非必須アミノ酸グリシンを用い、肺冷保存許容時間の延長と虚血再潅流傷害の改善を試みると同時に、傷害メカニズムの検討を行いました。
ラット肺をET-Kyoto液単独もしくはグリシン添加ET-Kyoto液を用いて冷保存したのち、既に作成した体外循環式肺潅流モデルを用いて再潅流を行い、肺酸素化能等の肺機能を比較検討しました。また、肺組織を特殊染色することで,再潅流後の酸化ストレスとアポトーシスの程度やそれらの相関関係を、さらに、アポトーシス経路を検討するため、TNF-alpha mRNAの発現を評価しました。
グリシンはアポトーシスや酸化ストレスを抑制することで肺冷虚血再潅流傷害を改善した。また、アポトーシスと酸化ストレスの程度は明らかに相関しました(Fig.3)。再潅流後の肺組織にTNF-alpha mRNAは発現しておらず、再潅流早期のアポトーシスはTNF-alphaと無関係に生じると考えられました。
7.気管移植
我々は気管移植に関しても臨床応用に向けた研究を、主として大型動物を用いてこれまで行ってきました。 まず、ドナー気管グラフトに高線量の放射線照射を行うことで、免疫原性が低下することを明らかにしました(J Thorac Cardiovasc Surg 1994)。
また、新たに開発したトレハロース含有凍結保存液を用いて1ヶ月の気管凍結保存が可能であることを示しました(J Thorac Cardiovasc Surg 1995)。
さらに長期間の凍結保存について検討し、9ヶ月、-85℃の気管凍結保存によって軟骨組織は正常に保たれているが、気道粘膜上皮は消失し、免疫原性が低下することを明らかにしました(J Thorac Cardiovasc Surg 1996)。 一方、ラットを用いた実験で、大網被覆は遊離気管グラフトに再血管誘導を早い時期から引き起こし、上皮の再生を促進することを示しました(Thorac Cardiovasc Surg 1992)。
しかし、大網被覆を行っても10軟骨輪の気管移植は困難であり、グラフト中心部に虚血性壊死が高率に発生することも示しました(Surg Today 1996)。
これらの研究により、移植後に生着可能な気管長は5軟骨輪が限界であることがわかりました。そこで、グラフト中心部を一部離断し、ここに大網を挿入固定する、いわゆるスプリット移植術式を開発し、この方法で10軟骨輪が生着可能であることを示しました (J Thorac Cardiovasc Surg 1996)。
《3》臨床肺移植と国際共同研究
京都大学医学部附属病院は、1998年肺移植実施認定4施設の一つに選定されました。
また、2001年には生体部分肺移植手術実施を京都大学医の倫理委員会に申請し、同委員会の承認を得ました。その後、2002年4月に、気管支拡張症の40歳代の女性に対し、夫と子をドナーとした京都大学呼吸器外科としては初の生体部分肺移植手術を行いました。この際に摘出したグラフト肺の灌流保存に当科で開発したET-Kyoto液を用いたことで、移植後の肺機能は極めて良好であり、同保存液の有効性が確認されました(Ann Thorac Surg 77: 338-9, 2004)。2002年8月には、原発性肺高血圧症の30歳代の女性に、青森県の脳死ドナーの方から提供された両側肺移植手術を施行しました。患者は術後2ヶ月で退院し、酸素が不要な生活を元気に送っています。2003年6月には敗血症からショックに陥った肺リンパ脈管筋腫症の20歳代の女性に緊急生体肺移植を施行しました。本手術でもET-Kyoto液を肺保存に使用し、高いリスクにもかかわらず、肺虚血再潅流傷害は軽度であった。2004年2月には肺気腫の30歳台男性に 両側脳死肺移植を施行しました。
今後は京都大学医学部附属病院で行われる臨床肺移植と並行して、分子生物学的、生化学的、あるいは肺生理学的手法を駆使して、臨床上の諸問題を解明していく予定です。
なお臨床及び研究面での世界の肺移植をリードする以下の大学及び病院に、医局員が過去に、または現在留学し、国際共同研究を行っています。
ワシントン大学(アメリカ)、ハーバード大学(アメリカ)、トロント大学(カナダ)、ハノーヴァー大学(ドイツ)、ザールラント大学(ドイツ)、トゥールーズ大学(フランス)