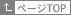京大呼吸器外科 京都大学医学部附属病院呼吸器外科
呼吸生理
《1》現在の研究
1.冷保存が肺のメカニクスに及ぼす影響
これまで保存肺の評価は、灌流後のガス交換能、血管内皮細胞の組織学的変化、血管内皮と上皮との膜透過性など、主に血管系を中心に評価されており、保存中の起こる気道系やそれを取り巻く細胞外マトリクスの変化について詳しい解析が行われていません。そこで現在我々は、保存後の肺の臓器レベルと組織レベルのメカニクスを測定し、保存肺における機械的特性(動的換気特性、粘弾性)の変化に注目し研究を行っています。これまで保存肺のメカニクスに関しては、圧ム量曲線から算出される静的コンプライアンスを用いた評価が主になされていますが、この方法では気道系や組織の機械的特性変化などの詳細な情報を得ることは困難です。そこで我々はforce oscillation technique(Flexi-vent, SIREQ)を用い、気道や組織における動的機械的特性の変化について気道系と抹消肺組織とを分別して検討しています。(Fig.1)さらに保存肺から4.5x4.5x10 mmの組織小片を切り出し、組織伸展装置(Scholar Tec)を用いてstress-strain curveを測定し、肺組織特性変化を詳細に検討しています。(Fig.2)これらの方法を用いることによってnon-heart beat ドナーへの臨床応用など新たな視点から保存肺の評価が可能になると考えています。
 fig.1 fig.1 |
 fig.2 fig.2 |
2. 人工ニュ−ロンネットワ−クを用いた 機能的電気刺激による呼吸と咳の再生と協調
本研究の目的は、様々な疾患・傷害によって損なわれた呼吸機能を社会復帰が可能なレベルに回復させる手段として、機能的電気刺激を用いた新しい呼吸確保の手段を確立することであります。
現在、脳梗塞・脳出血・脳腫瘍術後などの呼吸障害や、筋萎縮性側索硬化症など神経変性疾患患者の呼吸維持には、一般的に気管切開・陽圧式人工呼吸が用いられています。この方法は寝たきり患者にとっては十分ですが、病態の進行防止と運動や排便・排尿といった各種生理機能回復に関する医療が進歩すれば、広い行動範囲での活動を可能とする呼吸確保の新しい医療システムが、患者の社会復帰に必要となります。その際、対象患者の多くは気道の反射が低下しているため、換気を確保するだけでは不十分であり、咳反射や嚥下反射といった生理機能の確保もされねばなりません。
横隔神経の機能的電気刺激である横隔膜ペーシングは主として中枢性肺胞低換気症候群と高位頚髄損傷患者に対して行われてきましたが、心臓ペースメーカーほど広く普及するには至っていません。その理由として、ぺーサーの入手・メンテナンスの困難さと高額な医療費が挙げられますが、心臓ペースメーカーの例を見れば、患者の受益と患者の社会復帰による社会の負担の軽減が大きければこれらの要因は決して問題とはならないことがわかります。むしろ適応を制限しているのは、誤嚥や上気道閉塞に従来の横隔膜ぺーサーが対応できないことです。
咳や嚥下は呼吸運動と密に関連しており、その生じるタイミングによって前後の呼吸パターンが変化します。従来型のペーシング制御技術ではのような変化に対応することはできません。そこで、本研究ではまず、咳刺激が入力されたときに呼吸パターンが咳パターンに変化する神経機構を、ニュ−ロンネットワ−クモデルによって再構築し、呼吸と咳の切り替わりがどのような中枢神経機構で生じるのかを検討します。さらにこのモデルを用いたリアルタイム人工ニュ−ロンネットワ−ク制御を導入し、従来型の横隔膜ペーシングでは対応できなかった誤嚥や上気道閉塞の合併症に対して、横隔膜ペーシングに腹筋などの筋刺激を組み合わせた多チャンネル機能的電気刺激によって呼吸と咳機能の再生と協調を目指します。横隔神経へのアプローチは従来の開胸あるいは頚部アプローチよりはるかに侵襲の少ない胸腔鏡アプローチを新たに開発します。
3. 肺気腫の進行機序
呼吸器外科領域において、肺気腫患者の過膨張した肺に対する気腫肺減量手術(LVRS)の有効性が報告されており、この術式による患者のQuality of lifeの向上が期待されています。一方で、気腫肺減量手術の後にも、進行速度は落ちるものの肺気腫病変が進行することが問題となっています。これまで肺気腫進行の機序として、喫煙、環境因子、遺伝的素因によってプロテアーゼ、アンチプロテアーゼの量的、質的均衡が壊れ、肺内にあるエラスチン繊維がプロテアーゼを主体とする酵素による傷害を受ける、と説明されてきました。
近年エラスチン繊維のみならずコラゲナーゼを含むMatrix mettalloporteinase(MMP)等の活性化により、エラスチン繊維より強度の強いコラーゲン繊維の傷害がエラスチン繊維の傷害と同等かそれ以上に重要な要素と考えられてきました。しかし三嶋(京都大学呼吸器内科)らのCTを用いた気腫性病変のフラクタル解析で、気腫性病変の周辺には、新たな気腫性病変が生じ易いことが示唆されています。また、気道病変の少ない肺野病変主体の肺気腫患者さんでは、LVRS後の呼吸機能の低下が抑えられるとも考えられています。
そして、その原因として気腫性病変の周囲の組織にかかる機械的なストレスが強く気腫性病変周囲の肺胞壁が破壊されやすいことが考えられています
今後、我々は LVRS後の肺気腫の進展が酵素的な傷害のみならず、気腫性病変周囲の肺組織にかかる機械的stressが増大することより生じるメカニズムを検討します。
また、肺気腫における肺野病変と気道病変についてCTによる術前評価を行いLVRSに対しprospectiveな評価を行う予定です。